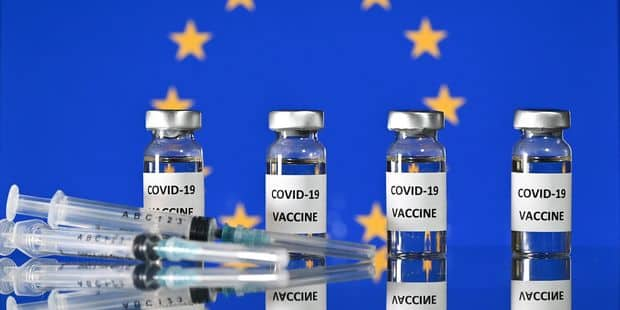
L’Agence européenne des médicaments (EMA) a décidé ce jour de donner une autorisation conditionnelle de mise sur le marché au Comirnaty, le vaccin à ARNMessager de chez Pfizer/BionTech, une technologie dérivée des thérapies géniques (1). Déclaration de Michele Rivasi, eurodéputée membre de Europe Écologie Les Verts, spécialiste des questions de santé publique :
« Je prends acte de la décision de l’EMA d’accorder une autorisation conditionnelle à ce vaccin génétique expérimental. L’EMA doit maintenant respecter son engagement de publier dans les trois jours après autorisation le contenu et les données de la demande d’autorisation fournie par les laboratoires pharmaceutiques.
Cette autorisation conditionnelle de mise sur le marché, fondée sur des données préliminaires, suppose que des études complémentaires seront fournies par Pfizer / Biontech au cours des 2 ans à venir.
Une pharmacovigilance renforcée est aussi prévue pour suivre les effets secondaires qui pourront apparaître suite aux premières injections du vaccin Comirnaty. Cela va constituer un challenge pour de nombreux pays européens qui n’auront pas les moyens, comme en France, de diffuser un bulletin hebdomadaire de suivi.
C’est un point de vigilance d’autant plus essentiel que les contrats d’achat anticipé liant l’Union européenne et les labos n’ayant toujours pas été rendus publics, on ne sait pas qui sera tenu responsable en cas d’apparition d’effets indésirables graves. »
Articles similaires :
- Pandemrix : Que cherche à cacher l’Agence Européenne des Médicaments?
- Covid-19 : La transparence est une condition de l’autorisation accélérée des médicaments !
- Pandemrix & Narcolepsie : l’Agence Européenne des Médicaments se range à l’évidence scientifique et déconseille les injections chez les moins de 20 ans
- Pandemrix : l’ECDC rejoint l’analyse de Michèle Rivasi et demande à l’EMA des décisions courageuses